کمی لومینسانس ایمنواسی و استفاده از آن در آزمایشگاههای تشخیص پزشکی
روش ایمنواسی اصولاً به آزمایشهایی گفته میشود که بر اساس اتصال آنتیبادی و آنتیژن بنا شده است. شاخهای از این آزمایشها را ایمنواسی بر پایه آنزیم گویند که در آن آنزیم خاصی با آنتیبادی نشاندار (کونژوگه) میشود تا سیگنالی (مانند رنگ یا نور) تولید کند که رابطه مستقیم یا غیرمستقیم با غلظت آنالیت درون نمونه داشته باشد. روشهای ایمنواسی میتواند به چند دسته تقسیم شود مانند رادیوایمنواسی، الایزا، کمی لومینسانس ایمنواسی و فلورسانس ایمنواسی. تفاوت در اکثر این روشها به مولکول نشاندارشده به آنتیبادی و نوع سیگنالی که تولید میکند، بستگی دارد.
روش رادیوایمنواسی اولین بار در سال 1959 توسط دو دانشمند با نامهای Yalow و Berson ابداع شد. آنها از I۱۲۵ به عنوان نشانگر استفاده کردند. اگرچه تکنیک رادیوایمنواسی روشی قابل اطمینان، معتبر و دقیق بودt اما رادیوایزوتوپها مشکلاتی از قبیل کوتاهی نیمهعمر و ایمنی را به وجود آورده بودند که امکان گسترش استفاده از آن را بسیار محدود کرده بود.
چند سال بعد دو دانشمند با نامهای Engvall و Perlmann در سال 1971 روش الایزا را ابداع کردند. از آن پس این روش بهطور گسترده در آزمایشگاههای تشخیص طبی، آسیبشناسی گیاهی و صنایع غذایی مورد استفاده قرار گرفت. با پیشرفت علم و نیاز آزمایشگاهها به تشخیص آنالیتهایی با غلظت کمتر، سمت و سوی تحقیقات به ابداع روشی حساستر، دقیقتر و سریعتر مانند فلورسانس و کمی لومینسانس رو آورد. در میان تکنیکهای ایمنواسی، روش الایزا رشدی بسیار سریع داشت.
استفاده از آن بسیار ایمنتر و آسانتر از رادیوایمنواسی بود. الایزا بر اساس رنگ تولیدشده از واکنش آنزیم کونژوگه با سوبسترای آنزیمی است. دانسیته این رنگ تولیدشده بر اساس قانون بیرلامبرت و منحنی استاندارد به غلظت تبدیل میشود. بههرحال حساسیت روش الایزا که مبتنی بر کالریمتری مرسوم است، نسبتاً پایین بود. به همین منظور ایمنواسی برای گسترش و افزایش حساسیت نیازمند تغییرات گستردهتر شد.
در سال 1985 یک دانشمند بنام Woodhead روش کمی لومینسانس ایمنواسی را ابداع نمود. در میان روشهای ایمنواسی، کمی لومینسانس ایمنواسی نماینده یک تکنیک چندکاره، فوق حساس با رنج وسیعی از کاربرد در آزمایشگاه ظهور کرد. امروزه این روش بهعنوان پرکاربردترین نسل تکنولوژی برای تشخیص در حوزه علوم آزمایشگاهی است. در این تکنیک از یک ماده لومینسانس بهعنوان نشانگر استفاده میشود. CLIA این امکان را فراهم کرد تا زمان انجام واکنش کوتاهتر شود و شرکتهای تولیدکننده کیتهای آزمایشگاهی بتوانند محصولات خود را در قالب یک سیستم بسته (Closed) بهصورت یک کارتریج تولید کنند تا بسیاری از خطاهای انسانی حذف شود. CLIA باعث کاهش مدت زمان آزمایش از یک و نیم ساعت به 45-30 دقیقه شد.
اگرچه CLIA حساسیت ایمنواسی را بهبود بخشید، اما اتصال مستقیم نشانگرهای لومینسانس به خاطر کوتاهی مدت زمان نشر نور استفاده از آن را بهصورت اتوماتیک محدود کرد. هرچه طول مدت تابش نور کمتر و سریعتر باشد، تمام انرژی برانگیختگی صرف تابش نور شده و فرصتی برای تبدیل نور به انرژی گرمایی و به هدر رفتن آن وجود ندارد. به همین دلیل چنانچه آزمایش به کمک رباتهای تمام اتوماتیک و بهصورت Closed انجام شود، خطاهای زمینهای حذف شده و راندمان و بازدهی کار نسبت به روش دستی آن بسیار بیشتر خواهد بود.
CLIA جایگزین خوبی برای RIA و ELISA برای تشخیص حساس و دقیق موادی مانند پروتئین، هورمون، دارو، اسیدهای نوکلئیک و آلودهکنندههای محیط زیست است. در سالهای اخیر، CLIA به علت حساسیت بالا، گستردگی رنج و کامل شدن روشهای اتوماسیون در حوضه بیوشیمی بالینی رشد فراوانی کرده است. CLIA با گسترش و کاربرد تکنولوژی آنتیبادیهای نوترکیب، نشانگرها و تکنیکهای وابسته، مواد فاز جامد و بهبود در عملکرد رباتها، بهعنوان روشی نوین ظهور کرد.
معرفها برای انجام واکنش نیاز به نشانگرهایی دارند که به آنتیبادی و یا آنتیژنهای خاصی متصل شوند و فرایندی را باعث شوند که در نهایت به تولید نور بیانجامد. از جمله این نشانگرها که بیشترین استفاده را در کمی لومینسانس ایمنواسی دارند میتوان به آنزیم فسفاتاز قلیایی، لومینول، ایزولومینول و مشتقات آن، اکریدین استر و HRP اشاره کرد. از مواد لومینسانسی که دارای پایینترین محدوده قابل اندازهگیری هستند میتوان به روشهای مبتنی بر آنزیم فسفاتاز قلیایی، لومینول، ایزولومینول و اکریدین استر اشاره کرد.
امروزه بیشترین کیتهای CLIA موجود در بازار جهانی منطبق بر آنزیم فسفاتاز قلیایی، ایزولومینول و اکریدین استر هستند؛ زیرا طبق مطالعات صورت گرفته بیشترین حساسیت و پایینترین LOD را دارند و برای سیستمهای بسته CLIA بسیار مناسب هستند و از طرف دیگر پایدارتر از مابقی لومینانسها میباشند و کاربری آنها بسیار راحتتر از بقیه مواد لومینسانس است.
اخیراً روشهایی که از سیستم میکروذرات مخصوصاً میکروذرات مغناطیسی بهعنوان فاز جامد در ایمنواسی استفاده میشود توجه دانشمندان را به خود معطوف کرده است. از مزایای این میکروذرات میشود به امکان تولید آنها در اندازههای مختلف و با خصوصیات منحصر به فرد نام برد. همچنین به علت اینکه این میکروذرات سازگاری خوبی با مواد زیستی دارند و از نظر اندازه با سایر مواد بیولوژیکی همخوانی مطلوبی دارند، به راحتی میتوانند به آنتیبادی متصل شوند و عملکرد خوبی داشته باشند. میکروذرات مغناطیسی باعث افزایش سطح اتصال آنتیبادی یا آنتیژنهای اختصاصی در مقایسه با سطح محدود هر چاهک در روش ELISA میشوند.
از طرف دیگر معلق بودن میکروذرات در ماتریکس نمونه باعث افزایش احتمال واکنش با آنالیت مورد نظر میشود. همین امر باعث افزایش حساسیت، تکرارپذیری بالا، افزایش گستره محدوده خوانش، بهبود در کمترین میزان قابل اندازهگیری و کاهش زمان واکنش CLIA در مقایسه با روشهای دیگر مانند ELISA میشود. همچنین محدوده خطی بالاتری در رنج وسیعتری از آنالیت موجود در نمونه خواهد داشت و میتواند آنالیتهایی با کمترین مقدار را اندازهگیری کند. جداسازی کمپلکس آنتیبادی-آنتیژن در روش CLIA بسیار آسانتر و سریعتر از روش ELISA است. تنها کافیست محیط واکنش در یک میدان مغناطیسی قرار بگیرد تا مواد واکنشگر که اتصال اختصاصی نداشتهاند شسته شود و فقط کمپلکس مورد نظر در کووت واکنش باقی بماند. همچنین میکروذرات پوشیده از آنتیبادی توانایی اتصال به آنالیتهای کوچک قرار گرفته در محلولی با مولکولهای بزرگ را نیز دارد.
شکل ۱: میکروذرات پوشیده شده با مواد و زنجیرههای جانبی مختلف
افزایش سطح اتصال آنتیبادی و افزایش احتمال تصادم مولکولهای واکنشگر یکی از عوامل مهم و تأثیرگذار در افزایش سرعت و بهبود عملکرد واکنش است. در سیستمهای CLIA جدید مانند دستگاه INDRA200 که از میکروذرات مغناطیسی استفاده میشود، این افزایش در سطح میکروذرات مغناطیسی چندین برابر سطح چاهک میکروپلیت در روش ELISA شده است. همچنین معلق بودن میکروذرات مغناطیسی در محیط واکنش باعث افزایش احتمال واکنش آنتیبادی با آنتیژن میشود. این عوامل باعث افزایش سرعت و عملکرد در سیستمهای بسته CLIA در مقایسه با روش الایزا شده است.
اندازه قابل تنظیم انتشار نور، طیف انتشار باریک، طیف تحریک گسترده و نقاط کوانتومی لومینسانس بسیار، در سیستمهای CLIA توجه دانشمندان را بهطور شگرف به خود جذب کرد تا از این سیستم بهعنوان یک روش حساس، دقیق و پرسرعت جهت گسترش علم تشخیص در آزمایشگاههای پاتوبیولوژی و تشخیص پزشکی استفاده کنند.
در روش الایزا برای جداسازی آنتیبادی متصل شده به آنالیت باید سطح داخلی چاهکهای پلیت با آنتیبادی پوشیده شود که این اتصال مستقیم آنتیبادی با سطح پلی استایرنی پلیت الایزا میتواند اثرات نامطلوبی مانند عدم تکرارپذیری، کاهش حساسیت و افزایش قیمت به دلیل استفاده از غلظتهای بالاتری از مواد بیولوژیک در آزمایش بگذارد؛ اما این نقصان در روش CLIA با گسترش علم میکرو ذرات مغناطیسی و استفاده از موادی مانند بیوتین-استرپتاویدین مرتفع گردیده است. آنتیبادی اختصاصی بر روی سطح میکروذرات مغناطیسی پوشیده میشود (کووت میشود) که با قرارگیری کووت در میدان مغناطیسی مطلوب با قدرت مشخص کمپلکس تشکیل شده میکروذرات با آنالیت هدف در چاهک باقی میماند و بقیه محلولها توسط سیستم شسته میشوند. در این حالت دیگر نیازی به پوشیدن سطح داخلی چاهک نیست.
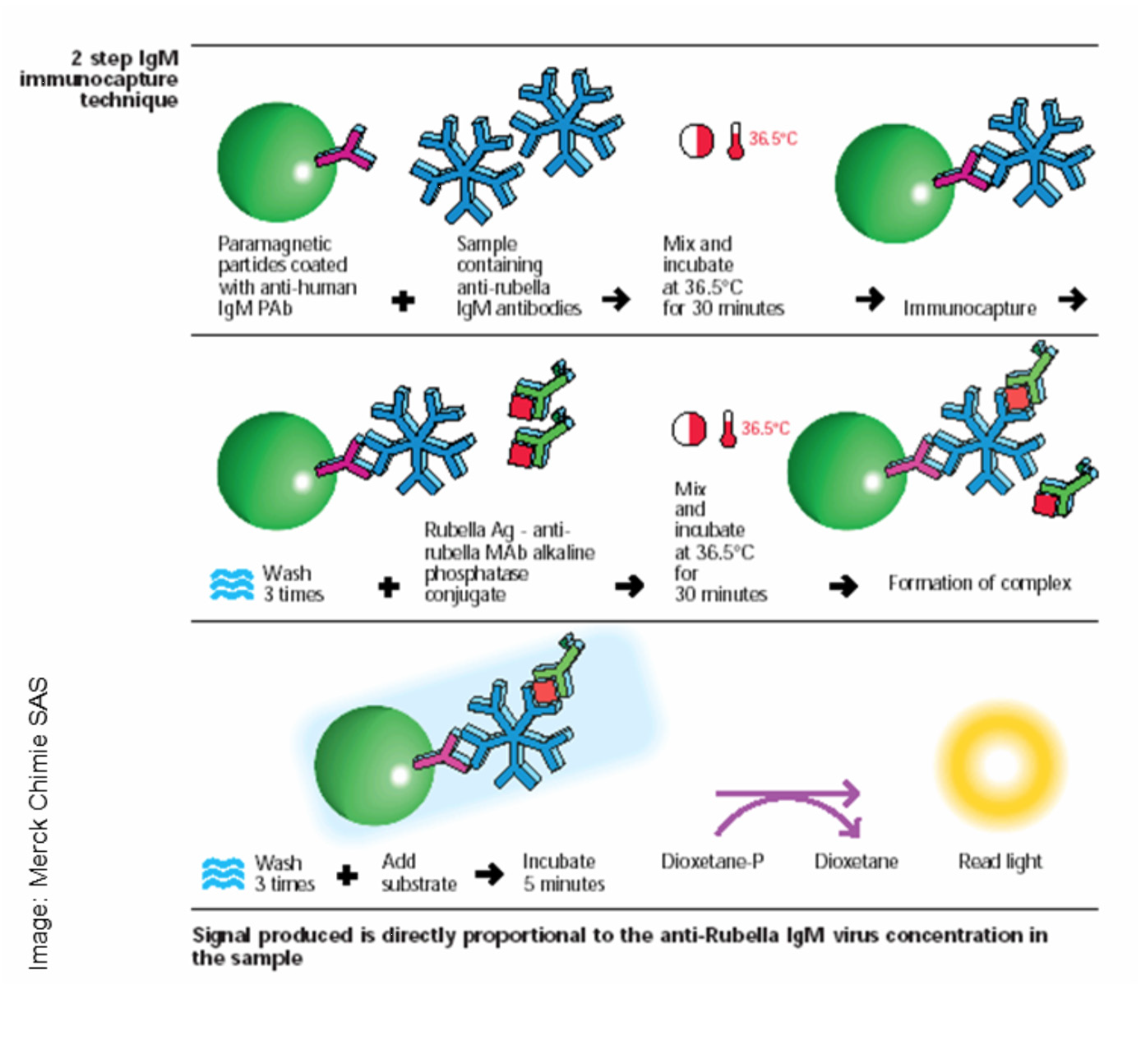
شکل ۲: طرح شماتیک یک روش اندازهگیری آنتیبادی IgM به روش کمی لومینسانس ایمنواسی
خصوصیات میکروبیدهای مغناطیسی استفاده شده در کیتهای تجاری بسیار متنوع هستند. اندازه هر مگنتیک میکروبید تأثیر مستقیم در سیستم جداسازی کمپلکس و همچنین سرعت رسوب در میدان مغناطیسی دارد. گروههای عاملی پوشیده شده در سطح میکروبیدهای مغناطیسی قدرت سیگنال تولیدشده را در کیتهای تجاری تعیین میکنند. هرچه سیگنال به وجود آمده بالاتر باشد، احتمال خطا در خوانش و تکرارپذیری کمتر خواهد بود. مقدار یون آهن استفاده شده در این میکروبیدها سرعت جداسازی فاز جامد از مایع را مشخص میکنند. اتصال گروههای عاملی به زنجیرههای آمین یا کربوکسیل آنتیبادی و آنتیژن، ثابت اتصال و جداسازی آنها و نیز پایداری اتصال شکل گرفته در سطح میکروبیدهای مغناطیسی تأثیر بسزایی در عملکرد روشهای بسته مبتنی بر تکنولوژی مگنتیک میکروبید و کمی لومینسانس دارند.
سیستمهای بسته رباتهای تمام خودکار در روش کمی لومینسانس عملکرد بسیار بهتری در مقایسه با روشهای دیگر اندازهگیری مواد بیولوژیک دارند. استفاده از سیستم جداسازی میکروبیدهای مغناطیسی و نشانگرهای کمی لومینسانس شاخصهای عملکردی آزمایش را در مقایسه با روشهای دیگر مانند الایزا تا حد چشمگیری افزایش داده است.
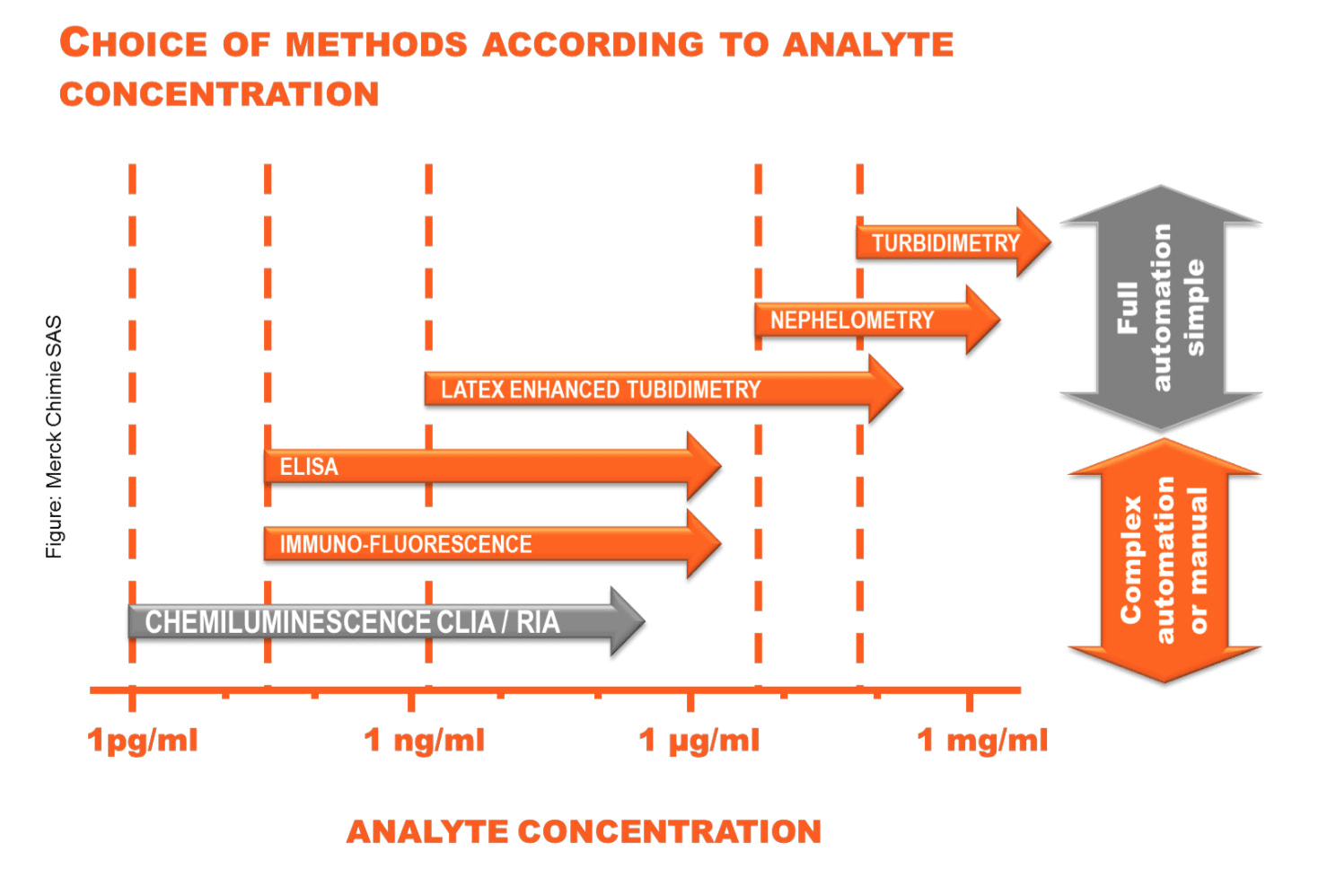
شکل ۳: مقایسه روشهای مختلف بر اساس توانایی آنها در اندازهگیری آنالیت هدف
بهطور کلی روش کمیلومینسانس ایمنواسی (CLIA) با بهرهگیری از نشانگرهای مناسب برای ردیابی آنتیژن، میکروذرات مغناطیسی برای افزایش سطح و جداسازی آنتیژن با سرعت و حساسیت و دقت بالا، استفاده از آنتیبادیهای منوکلونال و سیستمهای خوانشگر دقیق (PMT) که باعث افزایش حساسیت، محدوده خطی بیشتر (بعضاً تا 4 برابر فتومترهای الایزا)، افزایش تکرارپذیری، افزایش سرعت انجام واکنش، بهبود در کمترین حد خوانش (LOD)، کالیبراسیون مناسب با ضریب همبستگی بهتر و شیب خطی بالاتر که نشاندهنده حساسیت و دقت بیشتری در مقایسه با الایزا است، همبستگی خطی بهتر در رقتهای متوالی، احتمال وجود اثر هوک در غلظتهای بسیار بالاتر در مقایسه با روش الایزا، کاهش مقدار نمونه مورد آزمایش، کاهش مدت زمان انجام واکنش، کاهش زمان پاسخگویی به بیمار و اطمینان به جوابهای آزمایش بهعنوان یک جایگزین مطمئن برای روش الایزا است.



